Fernando Rodriguez Solana1, Eder Iván Zamarrón López1, Carlos Alfredo Galindo Martin2, Orlando Rubén Pérez Nieto4
- Unidad de Cuidados Intensivos, HGR #6 IMSS, Cd. Madero, Tamaulipas
- Servicio de Nutrición, Hospital San Angel Inn Universidad, CDMX
- Unidad de Cuidados Intensivos, Hospital General de San Juan del Rio, Qro.
Introducción
El ayuno no es benéfico para el paciente crítico, aunque ocasionalmente es necesario hasta lograr estabilización hemodinámica, resolución de la hipoxemia, etc. Por lo tanto, el paciente que de forma inadecuada se mantiene en ayuno tendrá mayor incidencia de desnutrición, aumento en la translocación bacteriana, miopatía, neuropatía, disminución de la respuesta inmune ante procesos infecciosos, ulceras gastroduodenales, neumonía asociada a la ventilación, entre otras. La mayoría de las veces se puede y se debe iniciar la vía enteral, a menos que no exista viabilidad del tubo digestivo; en ese caso se debería considerar retrasar el inicio de la nutrición enteral y/o instaurar una estrategia de nutrición parenteral. A continuación, te brindaremos 10 consejos para el inicio oportuno de este tipo de pacientes.
1. ¿Cómo realizar la evaluación del estado nutricional?
Todo paciente debería contar con al menos a su ingreso con una evaluación nutricional, y en la literatura se describen no menos de 30 herramientas. En el paciente hospitalizado la escala VGS, MUST y NRS-2002 han demostrado una sensibilidad y especificidad adecuada; en el paciente critico el NUTRIC SCORE (Tabla 1) sirve para identificar a los pacientes que se beneficiarían de la prescripción de nutrición enteral agresiva, empleando variables como la edad; escala de APACHE II, SOFA; número de comorbilidades y días previos al ingreso a UCI ¹ siendo esta por su versatilidad de mejor empleo para la valoración nutricional. El uso de esta escala se puede hacer junto con la exploración clínica buscando datos de desnutrición como pérdida de peso involuntaria y desgaste muscular, asociados a procesos inflamatorios o disminución de la ingesta o asimilación de nutrientes. Se deberá pensar en nutrición enteral temprana (<48h al ingreso) en todo paciente independientemente del riesgo, siendo que en aquel paciente de alto riego o desnutrición se podría beneficiar de lograr las metas calóricas posterior a la fase aguda temprana (día 1 a 2) y aquellos con bajo riesgo o sin desnutrición valorar aporte hipocalórico los primeros 7 días. ⁶
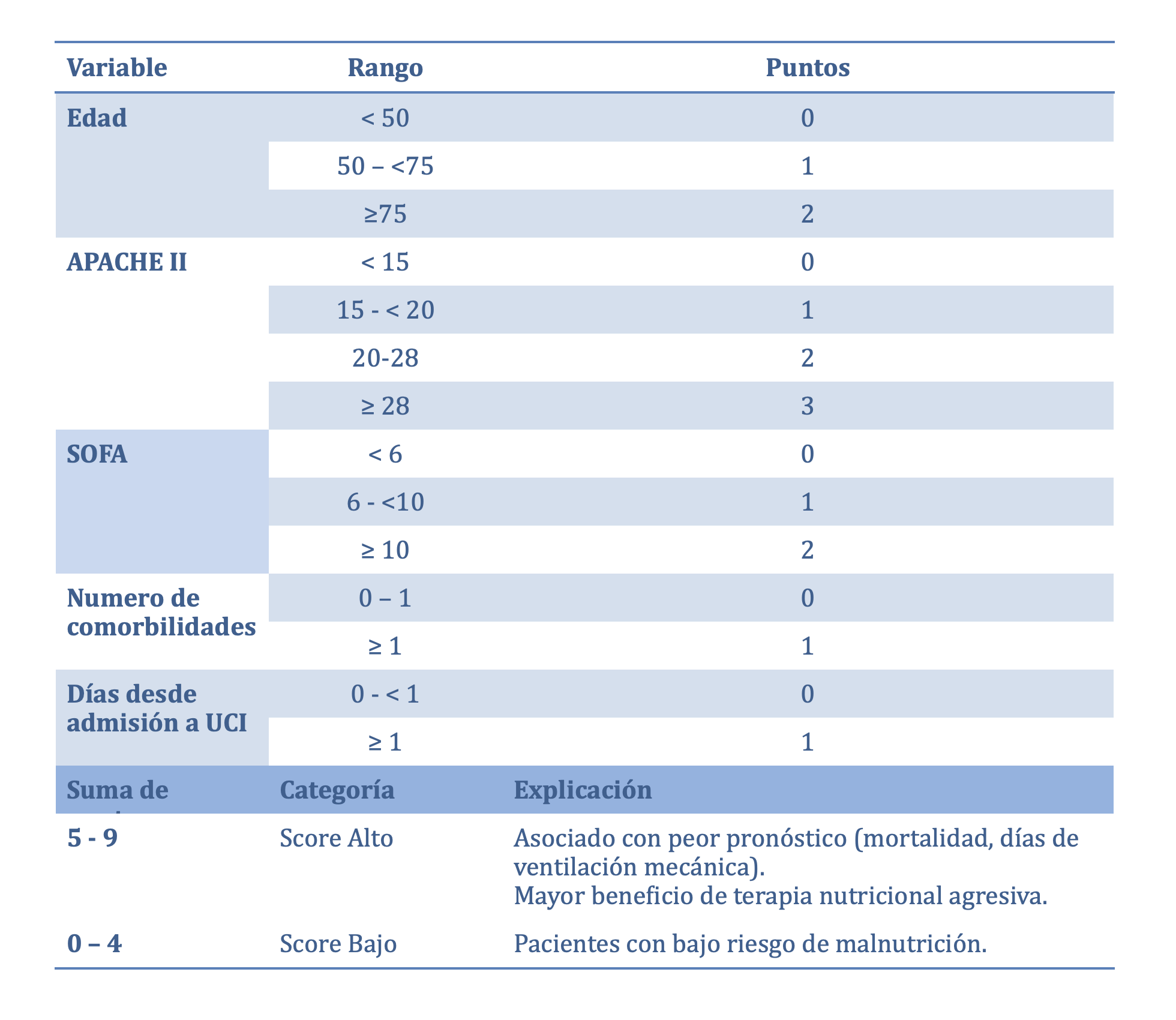
Tabla 1. NUTRIC score simplificada (Sin necesidad de medición de IL-6)¹⁵
2. ¿Infusión continua o intermitente?
Aunque no existe una evidencia que coloque en superioridad una respecto a otra, en metaanálisis se ha descubierto beneficios en la administración continua² como lo son mayor tolerancia a la alimentación y menor riesgo de aspiración.³ La administración de formula enteral sin interrupción durante 24 horas se asocia con una mayor deuda calórica al interrumpirse la infusión a lo largo del día por diversas causas (administración de fármacos enterales, movilización a estudios) proponiéndose la infusión a 20 horas.⁴ Por lo que se ha sugerido ajustar la infusión basada en volumen total, modificando la velocidad de infusión acorde al volumen restante para el día. El uso de infusión intermitente se ha propuesto como una medida más fisiológica la cual pudiera tener el beneficio de promover la síntesis proteica¹⁶ˉ¹⁷ (evitando el efecto “musculo lleno”), esto no se ha demostrado claramente, aunque la evidencia actual refiere que dicha infusión tiene un beneficio en el logro de metas nutricionales.¹⁸ˉ¹⁹ La medición de residuo gástrico no se ha recomendado de manera rutinaria ya que podría generar disminución del aporte nutrimental sin lograr mayor beneficio en la reducción de riesgos. ²⁰¯²¹
3. ¿Que sabemos respecto a la calorimetría indirecta?
Es la medición del consumo de O₂ (VO₂) y producción de CO₂ representando el metabolismo energético en tiempo real. Su empleo en relación con el uso de ecuaciones que calculan la demanda energética demuestra que puede prevenir la alimentación insuficiente y sobrealimentación. Además, se ha demostrado en metaanálisis una reducción en la mortalidad a 28 días en empleo de calorimetría indirecta con nutrición isocalórica. A pesar de estos beneficios, su costo y la inversión de dispositivos, consumibles, gas de calibración y servicio lo hace un método poco reproducible en nuestras unidades hospitalarias. ⁵
4. Si no cuento con calorimetría indirecta, ¿Cómo puedo calcular los requerimientos de mi paciente?
La recomendación de la ESPEN⁶, el uso de 25 kcal/kg tiene buena exactitud para empleo de la nutrición; considere que el inicio de la dieta enteral del paciente crítico no debe retrasarse más de 24-48 horas, así como la exploración de hábitos alimenticios previo a su ingreso. Muchos pacientes cuentan con ayunos de más de 24 horas previas a su ingreso al hospital, o en su defecto su valoración nutricional puede demostrar cierto grado de desnutrición. Por lo que se recomienda el empleo de dietas de ≈500 kcal/día o 10 kcal/kg e ir incrementando el aporte calórico hasta el máximo de 25 kcal/día en un lapso de 3-7 días, considerando la producción de energía endógena que llega a ascender hasta 500 – 1400 kcal/día¹⁴ y evitar el síndrome de sobrealimentación.
5. ¿Y si mi paciente tiene obesidad?
Las guías ASPEN recomiendan una alimentación hipocalórica e híper proteica, brindando el 65 a 70% de las necesidades calculadas o brindar 11-14 kcal/kg peso actual si IMC >30-50 kg/m² y 22-25 kcal/kg si IMC > 50 kg/ m².
6. No se te olviden las proteínas.
El catabolismo es un evento importante a tener en cuenta ya que la pérdida de hasta 1 kg/día de músculo, por lo que el considerar el aporte proteico en la dieta enteral es fundamental. Considerar que incluso un aporte reducido de hasta 0.6 g/kg se asoció con un destete temprano de la Ventilación mecánica y supervivencia más prolongada¹³, pero no olvidar su incremento hasta el objetivo: 1.3 g/kg/día. ¡No se olvide de movilizar a su paciente! Prevenga el Síndrome de debilidad adquirida. ⁶
7. ¿Licuada, artesanal o polimérica?
El empleo de la terminología en el ámbito hospitalario en muchas ocasiones suele ser heterogéneo, pero la dieta licuada y artesanal comparten el mismo concepto: preparación de alimentos mezclados (licuados) vertido en una bolsa para su administración en el paciente crítico que no cuenta con la vía oral disponible, se preparan con el fin de administrarlas por sondas naso u orogástrica, naso – yeyunales o de gastrostomía. ⁷ Idealmente se recomienda emplear un software⁸ para el cálculo de porciones, considere comunicarse con su servicio de Nutrición y Dieta para determinar la forma en que realizan el cálculo.
Por otro lado, la dieta polimérica en su formulación estándar isocalórica 1 kcal/ml provee los micronutrientes en su forma intacta en cantidades muy similares a la de una alimentación convencional. Considere que, para su administración requieren de una producción normal de enzimas pancreáticas para su digestión y absorción.
8. ¿Hiperglucemia en alimentación enteral?
Es una alteración común, muchas veces asociada con respuesta inflamatoria sistémica/trauma o empleo de fármacos corticoides, pero la gran asociación por nutrición con exceso de aporte calórico en muchas ocasiones es la alteración principal. Brinde manejo de la hiperglucemia y trate la causa⁹; monitorice la glucosa estrechamente. Evite el uso de fórmulas hidrolizadas por el alto aporte de carbohidratos. ¹⁰
9. Hiperglucemia 2.0
No solo los medicamentos que administramos como corticoides pueden incrementar los niveles de hiperglicemia, si usted no toma en cuenta las infusiones en su paciente provenientes del Propofol, soluciones glucosadas o administración de citrato pueden condicionar aportes de hasta ≈400 kcal por empleo de Propofol. Considere que la emulsión de Propofol 1 ml brinda 1.1 kcal. Así que contabilice su aporte y ajuste la dieta enteral para lograr su meta nutricional. ¹¹
10. ¿Qué es el síndrome de realimentación?
Es la manifestación plena en pacientes que cursan con ayunos prolongados, debido a indicación médica o curso de enfermedad crítica y el inicio abrupto con administración del total de requerimientos nutricios, la cual se presenta con alteraciones hidroelectrolíticas secundario al aumento abrupto de los niveles de insulina, así como metabólicas tras el reinicio de la alimentación. Suele presentarse en un lapso de 2 a 5 días de iniciada la alimentación. ¹² La detección clínica en el paciente critico resulta un reto debido a que en esta población las alteraciones observadas pueden ser multifactoriales y no solo por efecto del síndrome de realimentación, tales como rabdomiólisis, arritmias, edema, confusión o encefalopatía. Se recomienda detectar aquellos pacientes con alto riesgo e iniciar la administración de tiamina (200-300mg/día por 3 a 10 días), así como el incremento paulatino de calorías con monitoreo de electrolitos séricos, siendo la presencia de hipofosfatemia un indicador de dicho síndrome. Considerar el valor de corte para hipofosfatemia de relevancia como el decremento mayor a 0.5mg/dL logrando optimizar niveles séricos <2.0mg/dL dentro de las primeras 72h de inicio de alimentación. ²²
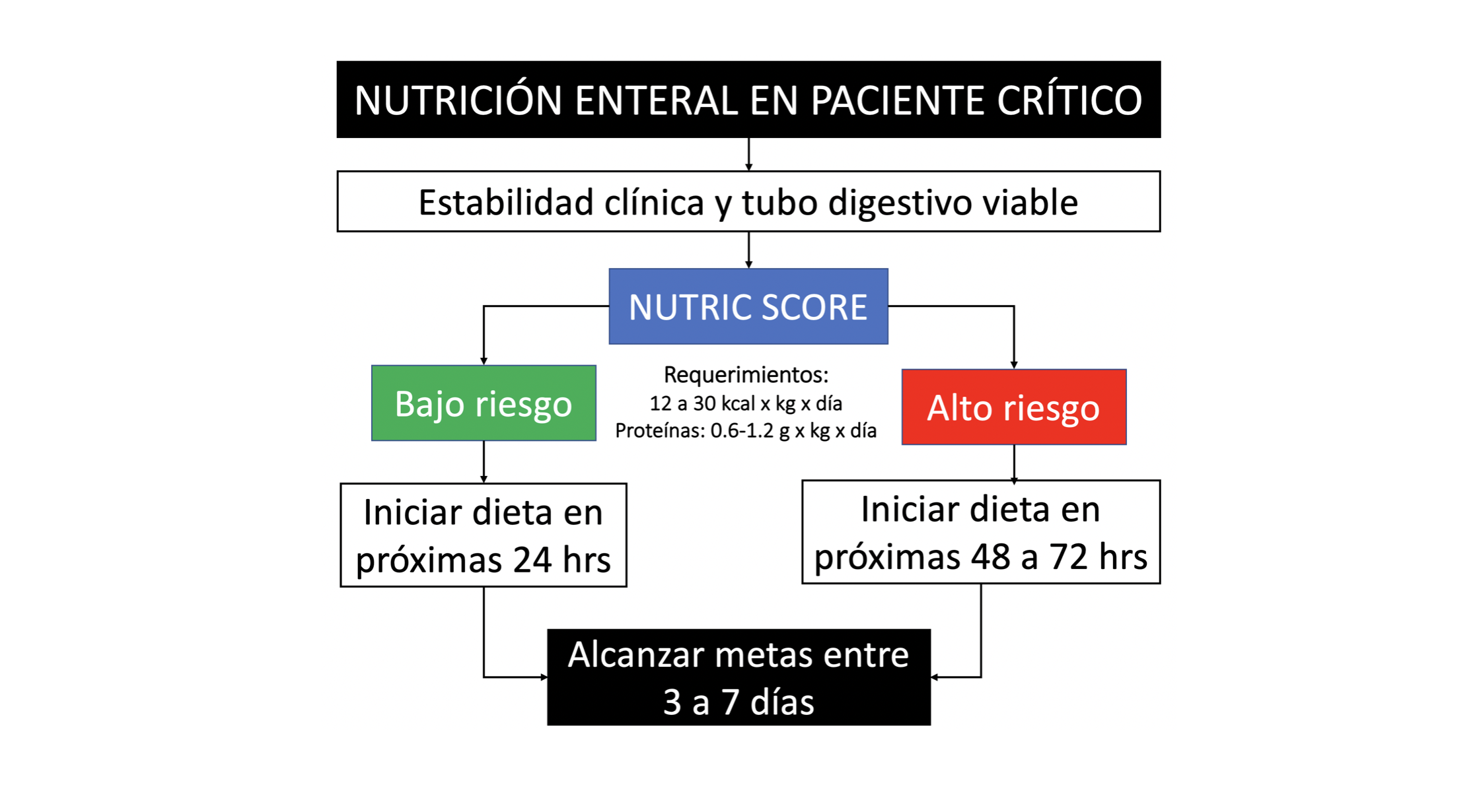
Figura 2. Algoritmo de estrategia para inicio de nutrición enteral
Conclusión
El arte de la práctica médica no solo consiste en diagnostica y brindar tratamiento al enfermo grave, el estudio y manejo integral con la nutrición y movilización del paciente podremos lograr reducir costos de hospitalización, días de estancia en áreas críticas y lo más importante: reincorporar a nuestro paciente a su entorno social con las menores secuelas y mayor funcionalidad del mismo.
Bibliografía
¹. Kyle UG, Kossovsky MP, Karsegard VL, Pichard C: Comparison of tolls for nutritional assessment and screening at hospital admission: a population study. Clin Nutr 2006;25:409-417
². Ma, Y., Cheng, J., Liu., Chen, K., Intermittent versus continuous enteral nutrition on feeding intolerance in critically ill adults: A meta-analysis of randomized controlled trials. International Journal of Nursing Studies, 113, 103783.
³. Hong-Yeul Lee. Continuous versus intermittent Enteral Tube Feeding for Critically Ill Patients: A Prospective, Randomized Controlled Trial. Nutrients 2022, 14(3), 664
⁴. Lichtenberg K, Guay-Berry P, Pipitone A, Bondy A, Rotello L: Compensatory Increased Enteral Feeding Goal Rates: A way to achieve optimal nutrition. Nutr Clin Pract. 2010;25(6):653-657
⁵. De Waele and van Zanten. Routine use of indirect calorimetry in critically ill patients: pros and cons. Critical Care (2022) 26:123
⁶. ESPEN guideline on clinical nutrition in the intensive care unit. Clinical Nutrition 38 (2019) 48-79
⁷. Walia C, Van Hoorn M, Edlbeck A, Feuling MB: The registered dietitian nutritionist’s guide to homemade tube feeding. J Acad Nutr Diet. 2017; 117(1):11-16
⁸. Borghi R, Araujo TD, Airoldi-Vieira RI et al.: ILSI Task Force on enteral nutrition: estimated composition and costo f blenderized diets. Nutr Hosp. 2013;28(6):2033-2038
⁹. Gosmanov AR, Umpierrez GE: Management of Hyperglycemia During Enteral and Parenteral Nutrition Therapy. Curr Diab Rep. 2013;13(1):155-162
¹º. Escuro AA, Humell AC: Enteral formulas in nutrition support practice: Is there a Better Choice for your patient? Nutr Clin Pract. 2016;31(6)709-722
¹¹. Yingxiao Huang. An analysis of non-nutritive calories from Propofol, dextrose, and citrate among critically ill patients receiving continuous renal replacement therapy. Jour of parenteral and enteral nutrition. 2022
¹². Skipper A: Refeeding syndrome or refeeding hypophosphatemia: a systematic review of cases. Nutr Clin Pract.2012;27(1):34-40.
¹³. Matejovic, M., Huet, O., Dams, K. et al. Medical nutrition therapy and clinical outcomes in critically ill adults: a European multinational, prospective observational cohort study (EuroPN). Crit Care 26, 143 (2022)
¹⁴. Tappy L, Schwatrz JM, Schneiter P, Cayeux C. Revelly JP, Fagerquist CKL, Effects of isoenergetic glucose.based or lipid based parenteral nutrition on glucose metabolism, de novo lipogenesis and respiratory gas exchanges in critically ill patients. Crit Care Med 1998;26:860-7
¹⁵. Rahman A. Hasan RM, Agarwala R, Martin C, Day AG, Heyland DK. Identifying critically-ill patients who will benefit most from nutritional therapy: Further validation of the “modified NUTRIC” nutritional risk assessment tool. Clin Nutr 2015.
¹⁶. Bharal, M., Morgan, S., Husain, T., Hilari, K., Morawiec, C., Harrison, K., Bassett, P., & Culkin, A. (2019). Volume based feeding versus rate based feeding in the critically ill: A UK study. Journal of the Intensive Care Society, 20(4), 299–308.
¹⁷.Flower, L., Haines, R., McNelly, A., Bear, D., Koelfat, K., & Damink, S. et al. (2021). Effect of intermittent or continuous feeding and amino acid concentration on urea‐to‐creatinine ratio in critical illness. Journal Of Parenteral And Enteral Nutrition, 46(4), 789-797.
¹⁸.McNelly, A., Bear, D., Connolly, B., Arbane, G., Allum, L., & Tarbhai, A. et al. (2020). Effect of Intermittent or Continuous Feed on Muscle Wasting in Critical Illness. Chest, 158(1), 183-194.
¹⁹.Bear, D., Hart, N., & Puthucheary, Z. (2018). Continuous or intermittent feeding. Current Opinion In Critical Care, 24(4), 256-261.
²⁰. Wang Z, Ding W, Fang Q, Zhang L, Liu X, Tang Z. Effects of not monitoring gastric residual volume in intensive care patients: A meta-analysis. Int J Nurs Stud. 2019 Mar;91:86-93.
²¹. Reignier J, Mercier E, Le Gouge A, et al. Effect of Not Monitoring Residual Gastric Volume on Risk of Ventilator-Associated Pneumonia in Adults Receiving Mechanical Ventilation and Early Enteral Feeding: A Randomized Controlled Trial. JAMA. 2013;309(3):249–256.
²². Galindo Martín, C., Mandujano González, J., Pérez Félix, M., & Mora Cruz, M. (2019). Síndrome de realimentación en el paciente críticamente enfermo: del metabolismo al pie de cama. Revista Mexicana De Patología Clínica., 154-159.






Orgulloso de mi amigo, mucho éxito
felicidades
Excelente texto, soy urgenciologo y en ocasiones en los servicios de salud pública permanecen pacientes críticos por las de 36 hrs y aún en ayuno sin saber las repercusiones que puede traer para ellos y peor aún desconociendo los beneficios que puede aportar, Excelente amigo, como siempre rompiendola, que orgullo 👏 💪🏽
Excelente información!
Excelente lo voy a recomendar
Excelente Blog
Excelente información